주기율표는 단순한 나열이 아닙니다. s-block, p-block, d-block, f-block이라는 4개의 블록으로 나뉘며, 각각 독특한 성질을 지닌 원소들이 존재합니다. 이 글에서는 블록별 원소의 위치, 전자배치, 대표 원소, 성질을 쉽고 명확하게 정리해드립니다.
주기율표는 왜 네 개의 블록으로 나뉘는 걸까?
우리가 학교에서 보는 주기율표는 단순히 줄 세워진 원소의 나열로 보이기 쉽지만, 사실 그 안에는 ‘전자 배치’라는 과학의 핵심 원리가 숨어 있습니다. 주기율표는 크게 s-block, p-block, d-block, f-block이라는 네 개의 구역으로 나눌 수 있으며, 각 블록은 원자 내 전자가 채워지는 궤도(오비탈)에 따라 구분됩니다. 이러한 블록 구분은 단순한 외형 정리가 아니라, 원소의 화학적 성질을 이해하는 핵심적인 단서가 됩니다. 예를 들어 알칼리 금속과 알칼리 토금속이 속한 s-block은 매우 반응성이 크고, p-block은 일상에서 자주 접하는 비금속 원소들이 몰려 있습니다. 반면, 전이금속이 모여 있는 d-block은 산업적 활용도가 높고, f-block은 희토류 원소와 방사성 원소 등 특수한 성질을 가진 원소들로 구성됩니다. 이 글에서는 주기율표의 블록 구분이 어떻게 이루어지는지, 각 블록별로 어떤 원소가 속하고 어떤 특징을 가지는지를 구조적으로 정리해보겠습니다.
s, p, d, f 블록의 특징과 대표 원소
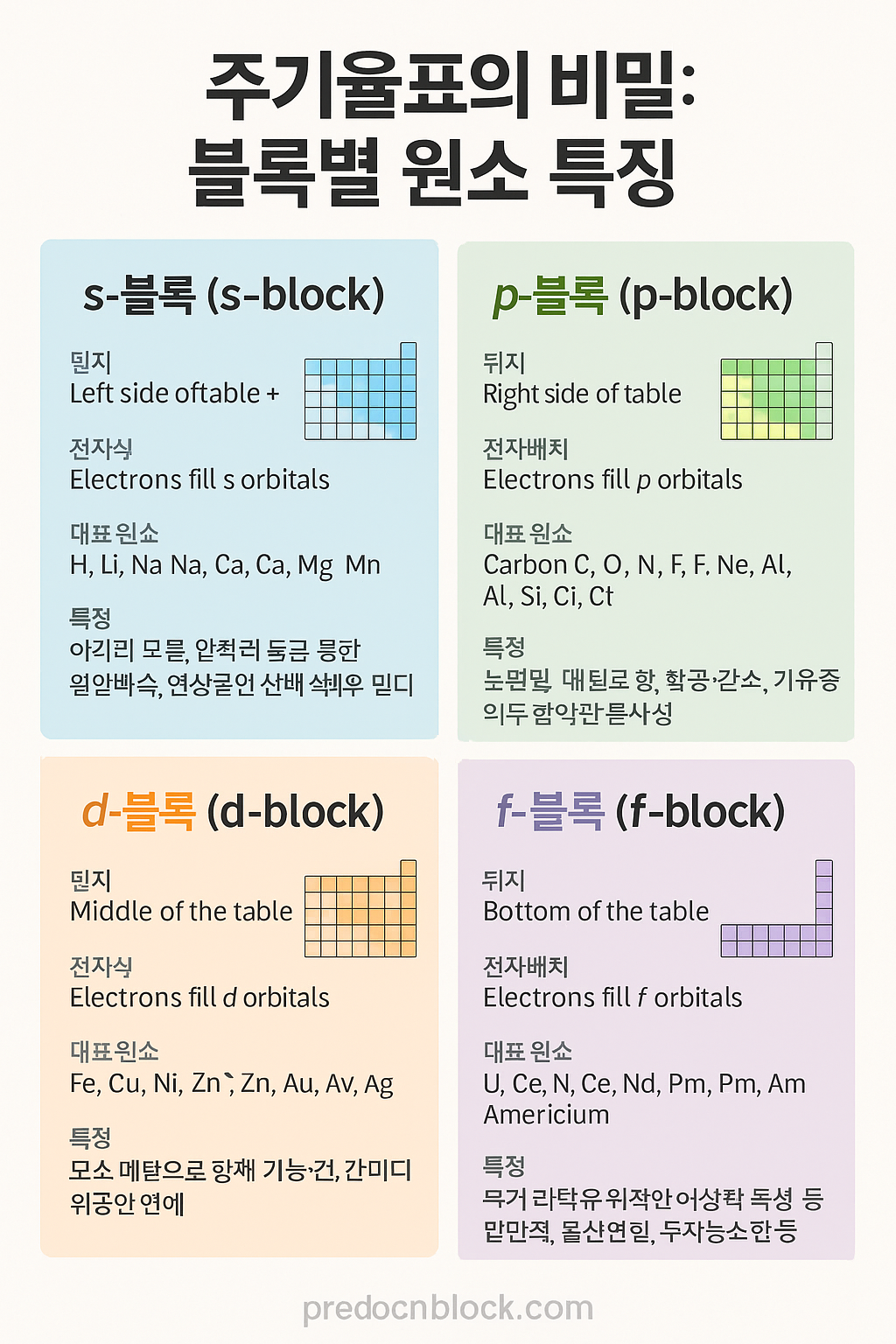
1. s-블록 (Group 1, 2, 헬륨 포함)
- 위치: 주기율표의 가장 왼쪽 + 헬륨
- 전자배치: s 오비탈에 전자가 채워지는 원소
- 대표 원소: 수소(H), 리튬(Li), 나트륨(Na), 칼슘(Ca), 마그네슘(Mg)
- 특징: 알칼리 금속과 알칼리 토금속 포함. 매우 반응성이 크며, 물과 반응하면 수소를 방출. 연성과 전성이 있고 대부분은 은백색의 부드러운 금속.
2. p-블록 (Group 13~18)
- 위치: 주기율표의 오른쪽
- 전자배치: p 오비탈에 전자가 채워짐
- 대표 원소: 탄소(C), 산소(O), 질소(N), 플루오린(F), 네온(Ne), 알루미늄(Al), 규소(Si), 염소(Cl)
- 특징: 비금속, 준금속, 할로겐, 비활성 기체 등 다양한 성질의 원소들이 존재. 생명체에 필수적인 원소 대부분이 p-block에 포함. 이산화탄소, 암모니아, 물, 염화나트륨 등 주요 화합물의 구성 성분이기도 함.
3. d-블록 (전이금속, Group 3~12)
- 위치: 주기율표의 가운데 영역
- 전자배치: d 오비탈에 전자가 채워지는 원소
- 대표 원소: 철(Fe), 구리(Cu), 니켈(Ni), 아연(Zn), 금(Au), 은(Ag), 크롬(Cr)
- 특징: 대부분 금속이며, 강한 금속 결합과 전도성. 산업용 소재로 다양하게 사용되며, 변색성 화합물 형성, 촉매 역할, 화합물에서 다양한 산화수를 가짐.
4. f-블록 (란타넘족 + 악티늄족)
- 위치: 주기율표 아래쪽 별도 블록
- 전자배치: f 오비탈에 전자가 채워지는 원소
- 대표 원소: 우라늄(U), 세륨(Ce), 네오디뮴(Nd), 프로메튬(Pm), 아메리슘(Am)
- 특징: 대부분 희토류 또는 방사성 원소. 특수 자성, 발광, 방사능 등의 성질을 지님. 고급 자석, 핵연료, 야광물질, 레이저 광원 등에 활용됨.
블록 구분은 왜 중요한가?
원소의 블록은 단순한 배열이 아니라, 전자배치 → 화학적 성질 → 활용 분야로 이어지는 연결 고리입니다. 예를 들어, p-block의 비금속 원소는 산화력이 강하고, d-block의 전이금속은 촉매로 쓰이며, f-block은 특수 장비에 필수적인 재료가 됩니다. 블록을 이해하면 원소의 용도와 반응성을 예측할 수 있어 화학 공부의 핵심이 됩니다.
블록별 주기율표, 원소의 성질을 여는 열쇠
주기율표는 단지 원소의 나열이 아니라, 전자 구조에 따른 질서와 논리를 담은 과학의 지도입니다. 이 지도 안에서 ‘블록’이라는 구분은 원소의 성격을 꿰뚫는 핵심 기준이며, 이 기준은 화학 반응, 물질의 성질, 기술적 활용까지 이어집니다. 예를 들어 전선에는 전도성이 뛰어난 d-블록 금속이 쓰이고, 공기 중 질소나 산소는 p-블록의 비금속이며, 신소재나 핵연료에는 f-블록 원소들이 꼭 필요합니다. 우리가 몰랐던 이 블록 구분은 단순히 과학자의 정리법이 아니라, 실제 세상에서 작용하는 물질의 법칙을 반영한 결과입니다. 앞으로 주기율표를 볼 때는 각 원소가 어느 블록에 속하는지를 한 번 더 살펴보세요. 단순한 표를 넘어, 원소들의 세계가 어떻게 구성되고, 어떻게 우리 삶에 영향을 주는지를 이해하는 데 큰 도움이 될 것입니다.